Винная кислота — различия между версиями
EvgBot (обсуждение | вклад) м |
EvgBot (обсуждение | вклад) м |
||
| Строка 26: | Строка 26: | ||
{{БЭСБЕ}} | {{БЭСБЕ}} | ||
| + | |||
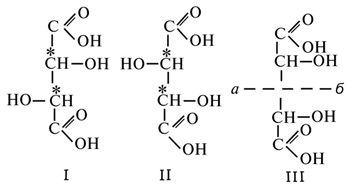
| + | '''Винные кислоты''', диоксиянтарные, двухосновные [[органические кислоты]] [[Файл:Винные кислоты (БСЭ).gif|middle]] с двумя асимметричными атомами углерода в молекуле. Известны все теоретически возможные В. к.: D-винная ([[Виннокаменная кислота|виннокаменная]]) кислота (I), растворы которой вращают плоскость поляризованного света вправо; её оптический антипод (см. ''[[Антиподы оптические]]'') — L-винная кислота (II); D, L-винная (виноградная) кислота (рацемическое соединение D- и L-B. к., см. ''[[Изомерия]]'') и мезовинная (антивинная) кислота (III), оптически недеятельная, что объясняется внутримолекулярной компенсацией вращения плоскости поляризации, обусловленной наличием дополнительной оси симметрии (''аб''). | ||
| + | |||
| + | [[Файл:Винные кислоты (БСЭ)1.gif|center]] | ||
| + | |||
| + | Наибольшее значение имеет D-B. к. (обыкновенная винная, или виннокаменная, кислота), которая в свободном состоянии или в виде солей содержится во многих плодах, особенно в [[виноград]]е. При брожении виноградного сока осаждается малорастворимая кислая калиевая соль D-B. к., так называемая [[винный камень]]. Получают D-винную кислоту действием минеральных кислот на её кислую калиевую соль. | ||
| + | |||
| + | D-винная кислота и её соли (тартраты) широко применяют в пищевой промышленности (например, при приготовлении [[лимонад]]ов и [[печенье|печенья]]), медицине (рвотный камень), при крашении, в органическом синтезе, аналитической химии и т.д. D-B. к. в щелочной среде растворяет Cu(OH)<sub>2</sub> с образованием прозрачного ярко-синего раствора — фелинговой жидкости, которая служит реактивом на восстановительную способность веществ. | ||
| + | |||
| + | ''В. Н. Фросин.'' | ||
| + | |||
| + | {{БСЭ}} | ||
== См. также == | == См. также == | ||
Текущая версия на 21:27, 15 марта 2014
Винная кислота
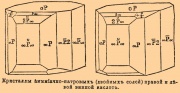
или виннокаменная (acide tartarique, tartaric acid, Weinsteinsäure) — C4H6О6, иначе диоксиянтарная — значительно распространена в растительном царстве, где она встречается свободной или в виде солей, напр. в картофеле, огурцах, исландском мхе, черном перце и т. д. Главным источником ее является виноградный сок, из которого она выделяется при брожении в виде труднорастворимой кислой калиевой соли — C4H5O6K — так называемого винного камня (crème de tartre, cream of tartar, Weinstein, argol), который был известен древним грекам и римлянам (под именем faex vint); последние знали, что при накаливании его остается щелочь (поташ), винная же кислота была из него выделена впервые Шееле (1769), разложившим серной кислотой ее известковую соль. Эта реакция применяется и теперь при техническом добывании винной кислоты (см. далее); для этого сырой винный камень (argol) нагревают с водой почти до кипения и прибавляют толченого мела до прекращения вскипания жидкости от выделяющейся угольной кислоты: 2С4Н5О6К + СаСО3 = С4СаH4О6 (в осадке) + K2C4H4O6 (в растворе) + СО2 (угольная кислота) + Н2О. Осадок отделяют декантацией, а раствор осаждают хлористым кальцием: К2С4Н4 О6 + СаСl2 = СаС4Н4О6 + 2КСl. Полученную тем или другим путем известковую соль промывают водой и разлагают избытком серной кислоты: СаС4Н4О6 + H2SO4 = С4Н6О6 + СаSО4 (гипс в осадке). Раствор сгущают, охлаждают, тогда выделяются кристаллы В. кислоты. Полученные кристаллы для очищения растворяют в воде, обесцвечивают животным углем и кристаллизуют фильтрат с прибавкой небольшого количества серной кислоты, в ящиках, выложенных свинцом. Прибавка серной кислоты имеет целью получение больших кристаллов, требуемых в торговле, но которые всегда содержат поэтому небольшие количества серной кислоты и свинца. Для окончательного очищения, когда таковое необходимо (напр. в фармации), В. кислоту перекристаллизовывают из воды. Чистая В. кислота представляет большие, прозрачные одноклиномерные призмы, уд. в. 1,764, плавится при 170° Ц. (Бишоф). Кристаллы сильно пироэлектричны и при растирании в темноте светятся подобно сахару. В. кислота обладает сильным, но приятным кислым вкусом, легко растворима в воде и спирте, трудно в эфире. Водные растворы ее вращают плоскость поляризации вправо (см. Вращательная способность), отчего она и получила название правой В. кислоты. Ее производные имеют довольно обширное применение в фармации и красильном деле. Как составная часть так называемых содовых порошков, она известна каждому; двойная соль калия и натрия (В. кислота двухосновна) — C4H4O6KNa + 4Н2O — сегнетова, или рошельская, соль (tartarus natronatus) употребляется как слабое слабительное; рвотный камень — двойная соль калия и сурьмы (tartarus emeticus, t. stibiatus) — (Sb2O2)(C4H4O6K)2 + Н2 O — как сильное рвотное, а в слабых дозах вызывающее испарину; tartarus ferratus (t. martialis) — двойная соль калия и закиси железа употребляется для железистых ванн. В красильном деле В. кислота употребляется для защищения от глиноземных и других протрав, а равно при приготовлении белого и розового рисунков по гладкому красному фону (rouge turc, türkischroth); в этом случае требуемый рисунок печатают по окрашенной ализарином ткани густым раствором В. кислоты и пропускают через так называемую хлорную барку, содержащую щелочной раствор белильной извести; по напечатанным местам образуется винно-известковая соль и хлорноватистая кислота, окисляющая ализарин во фталевую кислоту. Винный камень идет при окрашивании шерсти как прибавка к протраве с квасцами, хлорным оловом и т. д., результатом чего является, по-видимому, фиксирование волокнами глинозема в большем количестве и в более подходящей для окрашивания форме. Вследствие довольно высокой цены винного камня предложено много средств для замены его: многие из них представляют или смеси щавелевой кислоты, кислого сернокислого кали, квасцов, поваренной соли и т. д. (напр. proargol) или, как superargol — раствор того же винного камня, подкисленный серной кислотой. Как упомянуто выше, В. кислота двухосновна, что установлено не только составом ее солей, но и переходом при восстановлении йодистым водородом через деятельную (правовращающую) яблочную кислоту в янтарную кислоту; существование сложных эфиров, напр. ![]() доказывает ее четырехатомность. При сухой перегонке В. кислота дает кислоту пировиноградную: С4Н6О6 — СО2 — Н2О = С3Н4О3, получаемую также и из виноградной кислоты, откуда ее название, и пировинную С5Н8О4 = 2С3Н4О3 — СО2. Несравненно важнее наблюденное Пастером при нагревании до высокой температуры винных солей хинина и цинхонина — превращение ее в виноградную кислоту, более удобно получаемую нагреванием В. кислоты с небольшим количеством воды при 175° Ц. (Юнгфлейш; одновременно образуется мезовинная кислота — см. ниже). Виноградная кислота (Acide racémique, Traubensäure, acid. paratartaricum Berzelius’a) была известна уже с начала нынешнего столетия под названием вогезской кислоты (Säure aus den Voghesen) и принималась за нечистую щавелевую; тождество ее состава с В. кислотой (и их солей) установлено Берцелиусом, который впервые в этом случае предложил называть изомерными те химически однородные тела, которые «при одинаковом химическом составе и тождественном молекулярном весе — обладают различными свойствами».
доказывает ее четырехатомность. При сухой перегонке В. кислота дает кислоту пировиноградную: С4Н6О6 — СО2 — Н2О = С3Н4О3, получаемую также и из виноградной кислоты, откуда ее название, и пировинную С5Н8О4 = 2С3Н4О3 — СО2. Несравненно важнее наблюденное Пастером при нагревании до высокой температуры винных солей хинина и цинхонина — превращение ее в виноградную кислоту, более удобно получаемую нагреванием В. кислоты с небольшим количеством воды при 175° Ц. (Юнгфлейш; одновременно образуется мезовинная кислота — см. ниже). Виноградная кислота (Acide racémique, Traubensäure, acid. paratartaricum Berzelius’a) была известна уже с начала нынешнего столетия под названием вогезской кислоты (Säure aus den Voghesen) и принималась за нечистую щавелевую; тождество ее состава с В. кислотой (и их солей) установлено Берцелиусом, который впервые в этом случае предложил называть изомерными те химически однородные тела, которые «при одинаковом химическом составе и тождественном молекулярном весе — обладают различными свойствами».
Замечательно то объяснение изомерии, которое дал Био, нашедший в то же время, что виноградная кислота в отличие от В. кислоты не вращает плоскости поляризации: «тела, называемые изомерными, — говорит он, — представляют один из самых странных случаев химической механики. Содержа одинаковые весомые сущности, соединенные в одинаковых пропорциях, они обладают различными или по крайней мере некоторыми различными химическими отношениями, которые и заставляют признать в них различные молекулярные системы. Оба эти явления, на взгляд противоречивые, легко согласимы, если допустить, что в телах, о которых идет речь, неделимые сложные группы — обусловливающие химическое действие — содержат различное число подобных между собой атомов (частиц современной химии), образованных соединением элементарных сущностей, или что эти атомы, содержась в равном количестве, расположены между собой отлично, или, наконец, что оба рода различий имеют место одновременно. Высказанное представление о явлениях изомерии — является даже ее необходимым определением, если весомые сущности только одни образуют тела. Оно, по крайней мере, первое и наиболее простое, которого следовало бы держаться, пока не будет доказана его недостаточность».
По-видимому, в редких случаях виноградная кислота как таковая заключается в небольших количествах в виноградном соке; довольно частое получение ее в виде побочного продукта при добывании В. кислоты объясняется, однако, превращением этой последней, значительно облегчаемым присутствием солей глинозема (Юнгфлейш); верность такого объяснения подтверждается тем, что на фабрике Кестнера, который впервые нашел виноградную кислоту, она не получается после того как введено сгущение раствора В. кислоты в разреженном пространстве при 50° Ц.; наоборот, в некоторых английских фабриках, ведущих сгущение на голом огне, она образуется в значительном количестве (Вюрц). Впрочем, к превращениям способна не одна свободная В. кислота, а и соли ее и притом при сравнительно низкой температуре; так, по наблюдениям Лидова, при долговременном стоянии известковая соль В. кислоты в хлорной барке (см. выше) переходит в соль виноградной кислоты (хлорная барка не нагревается выше 50° Ц.). Из других реакций образования виноградной кислоты наиболее важны: кипячение серебряной соли дибромоянтарной кислоты с водой: СО2Ag-CHBr-СО2Ag + 2H2O = CO2HСН(ОН)-СН(ОН)-CO2H + 2AgBr, глиоксаля с синильной и соляной кислотой: СНО-СНО + 2HCN + 4Н2O + 2НСl = СООНСН(ОН)-СН(ОН)COOH + 2NH 4Cl (образующуюся при последней реакции кислоту, Штрекер назвал гликовинной; в обоих случаях одновременно образуется и мезовинная кислота) и окисление минеральным хамелеоном фумаровой кислоты СООН-СН=СН-СООН + О + H2О = СООН-СН(ОН)-СН(ОН)-СООН (Кекуле и Аншютц) и кислот пипериновой, циннамилакриловой и сорбиновой: RСН-СН-СН-СН-СООН + Н2О + O4 = R-CHO + COOHСН(ОН)-СН(ОН)СООН (Дебнер). От В. кислоты виноградная отличается: кристаллической формой — она кристаллизуется в триклиномерной системе, точкой плавления 203° — 206° Ц. (Бишоф), содержанием кристаллизационной воды (кристаллы ее [C4H6О6 + Н2О]2 поэтому, на воздухе вывариваясь, теряют блеск и становятся матовыми) и, наконец, тем, что растворы ее дают с раствором гипса осадок нерастворимой известковой соли (С4H4О9Са•4Н2О)2, растворимой в соляной кислоте, но выпадающей из раствора при усреднении его аммиаком и, следовательно, нерастворимой в растворе хлористого аммония.
Пастер показал, что виноградная кислота представляет соединение в частичных количествах обыкновенной винной кислоты с ее изомером, им же впервые открытым, вращающим плоскость поляризации влево и тем самым нейтрализирующим оптическую деятельность правой В. кислоты. Разделение удобнее всего достигается кристаллизацией насыщенного аммиаком раствора кислой натровой соли виноградной кислоты: образующиеся тогда большие, ромбические кристаллы оказываются обладающими то правыми, то левыми гемиэдрическими плоскостями +р/2 и -р/2; их механически отбирают друг от друга и выделяют кислоты обыкновенным путем: из кристаллов с правыми площадками получается правовращающая, а из других — левовращающая кислота. Образование энантиоморфных кристаллов облегчается, если в насыщенный раствор внести готовые уже кристаллы требуемых солей (Жернез, Юнгфлейш, Гор), но только в том случае, если температура раствора будет ниже 28° Ц., так как выше этой температуры выкристаллизовывается двойная аммонийно-натровая соль виноградной кислоты (C4H4NaNH4O6)2 + 2H2O (Штедель, Скани, Вырубов); это объясняется тем (Вант-Гофф), что выше 28° Ц. раствор пресыщен относительно виноградной соли, а ниже ее относительно смеси солей В. кислот (по криоскопическим наблюдениям Рауля, двойная аммонийно-натровая соль виноградной кислоты даже в насыщенном водном растворе разложена вполне на соли правой и левой В. кислот); темп. 28° Ц., при которой пересекаются кривые растворимости названных солей (то есть при которой их растворимость одинакова) представляет то, что Вант-Гофф предложил называть точкой перехода (point de transition). Вполне согласно с явлениями, наблюдаемыми над растворами, протекают превращения описанных солей в твердом виде, а именно: 1) при смешении мелко растертой аммонийно-натровой соли виноградной кислоты с водой в количестве отвечающем уравнению: (C4H4NaNH4O6)2•2Н2О + 6Н2О = 2C4H4NaNH4•4H2O, ниже 27° Ц., кашицеобразная масса застывает через некоторое время с образованием вполне сухой смеси солей В. кислот и 2) выше 28° Ц. эта сухая смесь становится по мере образования виноградной соли и связанного с этим превращением выделения воды (см. выше ур-ние) обратно полужидкой, то есть как бы начинает плавиться. Пастером же открыты и другие способы разделения В. кислот, а именно кристаллизация водных растворов виноградных солей хиницина и цинхоницина (соль хиницина и правой В. кислоты труднорастворима, соль цинхоницина труднорастворима для левой В. кислоты) и так называемый физиологический метод разделения, состоящий в культивировании спор плесени Penicillium glaucum в присутствии фосфорных солей в растворе кислой виноградно-аммонийной соли, причем исчезает (служит для питания) правая кислота. Оба эти приема, то есть кристаллизация соединений с оптически деятельными веществами и жизнедеятельность низших организмов, и до сих пор являются единственными общими методами разделения оптически деятельных изомеров. Аналогично солям относится и сама виноградная кислота: при обыкновенной температуре разведенные водные растворы ее, как показывают и термохимические (Бертело, Юнгфлейш, Ян) и криоскопические наблюдения (Рауль), представляют раствор смеси правой и левой В. кислоты; однако в насыщенном водном растворе около 6 % растворенной кислоты присутствует в виде виноградной (Рауль), а при слитии насыщенных водных растворов правой и левой В. кислоты наблюдается заметное выделение тепла и образование осадка кристаллов виноградной кислоты (Пастер). Подобное же явление наблюдается и при слитии эфиров обеих В. кислот (эфиры виноградной кислоты плавятся выше), но плотность их паров указывает на их полное распадение на эфиры В. кислот (Аншютц).
Левая винная кислота (Antiweinsäure, acide t. gauche) не встречается самостоятельно в природе; она по точке плавления (170° Ц.), растворимости и химическим свойствам ее самой и большинства ее производных представляет точное повторение свойств правой В. кислоты, отличаясь от нее кристаллической формой (представляет зеркальное изображение форм правой кислоты), действием растворов на поляризованный луч (вращает плоскость поляризации при равной концентрации на то же число градусов, но только в левую сторону), противоположными пироэлектрическими свойствами, отношением к низшим организмам и к органическим основаниям, обладающим оптической деятельностью; так, ее кислая аммонийная соль не дает кристаллической двойной соли с кислой аммонийной солью обыкновенной (правовращающей) яблочной кислоты и кристаллического соединения с аспарагином (соответственные соединения правой кислоты кристалличны). Нагретая с небольшим количеством воды до 175° Ц. левая кислота переходит в виноградную кислоту.
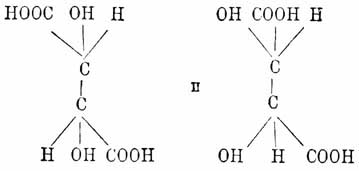
Мезовинная кислота (acide mesotartique, Mesoweinsäur, acide indedoublable) получена Пастером, наряду с виноградной, при нагревании виннокислого цинхонина, а затем Дессенем при окислении сорбита (C6H12O6). В больших количествах она образуется при нагревании винных кислот с водой до 165° Ц. (Юнгфлейш) и при окислении хамелеоном малеиновой кислоты (Кекуле, Аншютц) и фенола (Дебнер). Пржибытек получил ее при окислении разведенной азотной кислотой эритрита и глицерина, а Килиани — левулозы. Мезовинная кислота, подобно виноградной кислоте, кристаллизуется с одной частицей воды — C4Н6О6Н2О, плавится высушенная при 110° — при 143°, не действует на поляризованный свет, отличается большей растворимостью ее и ее солей, из которых известковая имеет состав — C4H4O6Ca•3Н2О; водные растворы не дают осадка с раствором гипса, и ее двойную аммонийно-натровую соль не удается разделить на соли правой и левой винных кислот. При нагревании с небольшим количеством воды при 175° Ц. мезовинная кислота дает виноградную кислоту. Таким образом, все четыре винных кислоты способны превращаться одна в другую, а принимая во внимание синтетические реакции их образования — они должны быть признаны структурно тождественными. Пастеру первому принадлежит попытка не только свести наблюдаемые различия в свойствах винных кислот на различия пространственного расположения атомов, их частицы составляющих, — что было сделано уже Био, — но и выяснить, в чем должно заключаться это различие пространственных отношений. А именно, по его убеждению — вращение плоскости поляризации для веществ, обладающих этой способностью даже в растворах, обусловлено асимметрией их частиц, асимметрией, которая сказывается в энантиоморфной гемиэдрии кристаллов данных веществ; а потому, хотя мы и не знаем «сгруппированы ли атомы правой винной кислоты в виде спирали, закрученной в правую сторону, или же они расположены по углам неправильного тетраэдра, или каким-нибудь другим асимметричным способом, — но что не может подлежать ни малейшему сомнению, так это то, что мы имеем дело с асимметричными расположениями, изображения которых взаимно не покрываются. Кроме того, одинаково достоверно, что атомы левой кислоты сгруппированы прямо противоположно атомам правой кислоты. Наконец, несомненно, что виноградная кислота образуется соединением двух групп, состоящих из противоположно-асимметричных частиц». Воззрения Пастера целиком легли в основу современной теории пространственного расположения атомов в частицах органических соединений, которая исходит из положения, что направление четырех равнозначных единиц сродства углеродного атома отвечает в пространстве направлению линий, соединяющих углы правильного тетраэдра с центром описанного вокруг него шара (углеродный атом считается находящимся в этом центре; по Вислиценусу, сам углеродный атом тетраэдричен) и что атомы или группы, связанные отдельными единицами углеродного сродства (то есть расположенные по углам предполагаемого тетраэдра), не могут произвольно менять своего относительного пространственного положения (Вант-Гофф; о воззрениях Ле Беля и его участии в развитии пространственных химических представлений — см. Стереохимия). При этих допущениях четырехзамещенные производные метана, то есть частицы вида Cabcd (нaпp. молочная кислота — 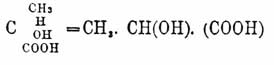 = СН3 -СН(ОН)-(СООН) мыслимы в двух энантиоморфных формах (одно представляет зеркальное изображение другой), обусловленных отсутствием плоскостей симметрии в построенных таким образом частицах. Для приведенной частицы мыслимы только две таких формы оптически деятельных вследствие асимметрии (по положению Пастера приведенному выше) и обладающих равной, но противоположной вращательной способностью; кроме того, как продукт соединения двух таких частиц мыслимо вещество, не действующее на поляризованный луч, но в подходящих условиях способное быть разложенным обратно на вошедшие в состав его частицы (corps racemique ou inactive par compensation Пастера). Явление усложняется в том случае, если в частице соединения имеется не один атом углерода, соединенный с четырьмя разнородными атомами или группами и называемый по предложению Вант-Гоффа асимметричным, а несколько. В случае, напр., винной кислоты, таковых два, а именно (СООН)С(ОН)(Н)•(Н)(ОН)С(СООН), напечатанных курсивом, и тут, кроме трех случаев, описанных выше, то есть двух асимметричных частиц, равно вращающих плоскость поляризации соответственно в правую и левую стороны, графически изображаемых формулами:
= СН3 -СН(ОН)-(СООН) мыслимы в двух энантиоморфных формах (одно представляет зеркальное изображение другой), обусловленных отсутствием плоскостей симметрии в построенных таким образом частицах. Для приведенной частицы мыслимы только две таких формы оптически деятельных вследствие асимметрии (по положению Пастера приведенному выше) и обладающих равной, но противоположной вращательной способностью; кроме того, как продукт соединения двух таких частиц мыслимо вещество, не действующее на поляризованный луч, но в подходящих условиях способное быть разложенным обратно на вошедшие в состав его частицы (corps racemique ou inactive par compensation Пастера). Явление усложняется в том случае, если в частице соединения имеется не один атом углерода, соединенный с четырьмя разнородными атомами или группами и называемый по предложению Вант-Гоффа асимметричным, а несколько. В случае, напр., винной кислоты, таковых два, а именно (СООН)С(ОН)(Н)•(Н)(ОН)С(СООН), напечатанных курсивом, и тут, кроме трех случаев, описанных выше, то есть двух асимметричных частиц, равно вращающих плоскость поляризации соответственно в правую и левую стороны, графически изображаемых формулами:
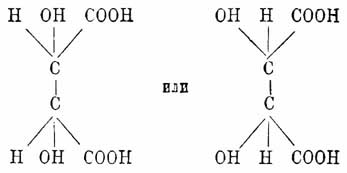
и продукта соединения их, оптически недеятельного (виноградная кислота), — мыслим еще случай, когда система одноатомных групп, связанных с одним асимметричным атомом углерода, будет являться зеркальным изображением системы, соединенной с другим углеродным атомом (случай, возможный только при тождестве групп, находящихся при обоих асимметричных атомах углерода, понятно); тогда мы будем иметь в одной и той же частице две энантиоморфные тождественные формы, которые и будут взаимно друг друга компенсировать, а следовательно, вещество такого строения не только будет оптически недеятельным, но, представляя цельную частицу, оно не будет способно разделяться такими простыми физическими операциями, как кристаллизация солей, на оптически деятельные изомеры (corps inactif du type indédoublable Пастера), что и известно, как было видно выше, для мезовинной кислоты, которая при излагаемом воззрении получает одну из следующих формул:
(обе формулы тождественны, но одна относительно другой перевернута на оси, перпендикулярной к связи, соединяющей асимметричные углеродные атомы, на 180°). Для системы, содержащей два асимметричных атома углерода, других случаев изомерии не мыслимо, относительно же количества возможных теоретически изомеров для тел, содержащих n асимметричных углеродных атомов, см. Стереохимия.
- В статье воспроизведен материал из Большого энциклопедического словаря Брокгауза и Ефрона.
Винные кислоты, диоксиянтарные, двухосновные органические кислоты ![]() с двумя асимметричными атомами углерода в молекуле. Известны все теоретически возможные В. к.: D-винная (виннокаменная) кислота (I), растворы которой вращают плоскость поляризованного света вправо; её оптический антипод (см. Антиподы оптические) — L-винная кислота (II); D, L-винная (виноградная) кислота (рацемическое соединение D- и L-B. к., см. Изомерия) и мезовинная (антивинная) кислота (III), оптически недеятельная, что объясняется внутримолекулярной компенсацией вращения плоскости поляризации, обусловленной наличием дополнительной оси симметрии (аб).
с двумя асимметричными атомами углерода в молекуле. Известны все теоретически возможные В. к.: D-винная (виннокаменная) кислота (I), растворы которой вращают плоскость поляризованного света вправо; её оптический антипод (см. Антиподы оптические) — L-винная кислота (II); D, L-винная (виноградная) кислота (рацемическое соединение D- и L-B. к., см. Изомерия) и мезовинная (антивинная) кислота (III), оптически недеятельная, что объясняется внутримолекулярной компенсацией вращения плоскости поляризации, обусловленной наличием дополнительной оси симметрии (аб).
Наибольшее значение имеет D-B. к. (обыкновенная винная, или виннокаменная, кислота), которая в свободном состоянии или в виде солей содержится во многих плодах, особенно в винограде. При брожении виноградного сока осаждается малорастворимая кислая калиевая соль D-B. к., так называемая винный камень. Получают D-винную кислоту действием минеральных кислот на её кислую калиевую соль.
D-винная кислота и её соли (тартраты) широко применяют в пищевой промышленности (например, при приготовлении лимонадов и печенья), медицине (рвотный камень), при крашении, в органическом синтезе, аналитической химии и т.д. D-B. к. в щелочной среде растворяет Cu(OH)2 с образованием прозрачного ярко-синего раствора — фелинговой жидкости, которая служит реактивом на восстановительную способность веществ.
В. Н. Фросин.
- Эта статья или раздел использует текст Большой советской энциклопедии.